Al pensar en temperatura se nos puede venir a la mente cuestiones como algo frió o caliente, y durante años se ha querido llevar muchos estudios para caracterizar dicha propiedad de la materia, debo confesar que la temperatura es un de los parámetros mas difíciles de controlar, por ejemplo si usted tiene un sistema y quisiera controlar su temperatura no lo puede hacer de manera inmediata, porque cambiar de temperatura un cuerpo o sistema es un proceso lento.Si ahondamos un poco mas nos daríamos cuenta que la temperatura esta relacionada con los movimientos internos de las partículas o moléculas, a esta se le llama comúnmente energía interna, entonces a mayor movimiento de partículas o lo mismo a mayor energía interna el cuerpo estará mas caliente.
Que pasa en un material solido, en este caso las partículas tienen menor movimiento, están como vibrando en su misma posición, pero no se puede afirmar que estén quietas, existe un movimiento pero leve, en el caso de un gas, las partículas se desplazan de un lado a otro y están chocando entre si. En algunos tipos de gases se debe considerar no solo la traslación sino la rotación de las partículas.
Te habrás dado cuenta que la temperatura de un cuerpo varia cuando cambia alguna de sus propiedades, por ejemplo cuando pasa de estado solido a gas, cuando dos sustancias se combinan, pueden desprender calor, aumentando la temperatura, si se intenta presionar un gas, o tan solo hacer circular corriente eléctrica por un conductor, este se puede calentar.
La temperatura se medirá con un termómetro, existen varias escalas, para el Sistema Internacional de Unidades, la unidad de temperatura es el kelvin (K). Digamos que esta escala es mas usada en el circulo de investigación, sin embargo las mas conocida es la escala de Grados Centígrados (ºC), en Norte América es de uso extendido el la escala Fahrenheit, También se usa a veces la escala Rankine (°R). En la figura siguiente se muestra las equivalencias entre las distintas escalas.
Esta ley esta relacionada con el concepto de equilibrio térmico, veamos esta situación de la siguiente manera, imagina dos cuerpos cualesquiera, estos tienen diferente temperatura, ahora hagamos que entren en contacto, que se junten, que crees que puede ocurrir?. Lógico habrá transferencia de calor entre ellos, ahora veamos estos dos cuerpos como un sistema, se dice que el sistema está en equilibrio térmico cuando ya no exista mas transferencia de calor entre sus partes, cuando la temperatura sea una sola para el conjunto.
Expresemos la ley cero, que dice que si dos cuerpos C1 y C2 están en equilibrio térmico con un tercero C3, entonces los cuerpos C1 y C2 estan en equilibrio térmico entre sí. Entonces estos compartirán algo en común, la denominada temperatura empírica. este principio esta basado en la observación empírica mas que la teórica.
3. Dilatación de sólidos y líquidos
Todo cuerpo tiende a dilatarse por acción de la temperatura, quiere decir que puede aumentar su longitud o volumen cuando se le somete a un cambio de temperatura , generada de diversas forma o cualquier medio, ya sea utilizando medios inflamables o aplicando algún tipo de fricción. Si se quisiera hacer el proceso inverso se debería disminuir la temperatura.
Dilatación lineal.- Se entiende que la dilatación se dará en un sola dimensión. Sigamos el siguiente análisis.
L0 = longitud inicial.
L = longitud final.
ΔL = dilatación (DL > 0) ó contracción (DL < 0)
ΔT = Tf – Ti (variación de la temperatura)
α = coeficiente de dilatación lineal [°C-1]
Dilatación Superficial
Dilatación Volumétrica
Dilatación en líquidos.- Cuando los líquidos se calientan es más difícil medir el cambio de volumen que experimentan que en los sólidos, porque, al calentar el líquido, también se dilata el recipiente que lo contiene.
Los líquidos tienen mayores coeficientes de dilatación que los sólidos, aunque no son constantes: varían con la temperatura. El mercurio es el líquido con coeficiente de dilatación más constante; por eso se utilizó en los termómetros.
El agua es un líquido que se comporta de manera anómala en la dilatación. Entre 0 y 4 °C, el agua líquida, en vez de aumentar su volumen, se contrae. La consecuencia de esta contracción de volumen es un aumento de la densidad. La densidad del agua es máxima a 4 °C.
Fuente: DilatacionDeLiquidos 4. Conceptos de calor, caloría
En días de verano, los rayos del sol nos pueden ocasionar una sensación de calor. Ahora el estudio de física lo considera una forma de energía que se trasmite entre diferentes cuerpos, esta transferencia es posible cuando los cuerpos están a diferentes temperaturas, podemos hacer equivalentes los términos transferencia de energía y calor. Tener presente que la trasferencia de energía o calor se da de un cuerpo mas caliente a uno mas frió, hasta que ambos lleguen al equilibrio térmico. Importante observar que los cuerpos no tienen calor sino energía térmica. Entonces podemos concluir que el calor es el proceso que permite la transferencia de energía de un cuerpo a otro, debido a la diferencia de temperatura de los mismos.
La caloría?, es la unidad de la energía (símbolo cal), osea las unidades en que serán medidas, una pequeña observación esta unidad pertenece al Sistema técnico de Unidades (actualmente esta en desuso), que estuvo basada en el calor especifico del agua. Actualmente se utiliza el Julio o Joule (SI).
Pero a que equivale una caloría? Esta es la energía necesaria para elevar la temperatura de un gramo de agua pura, desde 14.5 a 15.5 ºC, bajo una presión de una atmósfera. Entonces una caloría (cal) equivale a 4,1869 julios (J). Para obtener la cantidad de calo Q , se utliza la siguiente formula física:

donde
 es la masa,
es la masa,  el calor específico y
el calor específico y 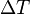 el incremento de temperatura que experimenta el cuerpo.
el incremento de temperatura que experimenta el cuerpo.Nota: La calorías también se utilizan para expresar en poder energético de algunos alimentos.
El calor específico.- Es la cantidad de calor que se debe suministrar a cierta masa (generalmente pequeña), para elevar su temperatura en una unidad. tomemos un gramo de agua, se necesita 1 cal para cambiar su temperatura en un grado ºC, es por eso que el calor especifico del agua es 1 cal/gºC.
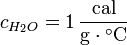
El calor especifico de un material depende de su temperatura, debido a que en muchos procesos la variación es mínima que puede considerar el calor específico como constante.
Capacidad Calorífica .- En este caso ya no tengo una masa pequeña si no una masa grande, veamos de esta manera, ahora tomemos 100 g de agua, cuantos cal necesito para que aumente su temperatura un grado?? exacto 100 cal, que hicimos multiplicamos 100 por el calor especifico del agua, a ese valor obtenido le denominaras Capacidad calorífica te das cuenta que depende de la masa, y si ahora te pregunto cual es la capacidad calorífica de 200 g de agua?, creo que podrás responder sin dudaNota: densidad del agua:
Densidad H2O= 1kg/L= 1000Kg/m^3= 1g/ml= 1g/cc= 1g/cm^3
Calor latente.- Es la energía requerida por una cantidad de sustancia para cambiar de fase, de sólido a líquido (calor de fusión) o de líquido a gaseoso (calor de vaporización).Se debe tener en cuenta que esta energía en forma de calor se invierte para el cambio de fase y no para un aumento de la temperatura.
Nota:
Nota:
- El calor específico del agua sólida es 0,5 cal/g.ºC = 2090 J/kg.ºC.
- Agua líquida es 1 cal / g.ºC = 4186 J/kg.ºC.
- Vapor de agua es 0,482 cal/ g.ºC = 2020 J/kg.ºC.
James Prescott Joule en 1845, escribió en un papel, que existe relación entre la energía mecánica y la cantidad de calor producido, para esto utilizo una pequeña maquina que constaba de pesas atadas a un espiral que movía unas aspas. Con esto Joules demostró que para una misma cantidad de trabajo, se obtiene la misma cantidad de calor, podemos escribir W=Q, a esta igualdad el científico le denomino equivalente mecánico de calor.
6. Cambios de estado
6. Cambios de estado
La materia puede cambiar estado, puede pasar de solido a liquido, o de liquido a gas, cuando ocurre esto se dice que la materia ha cambiado de estado o fase, también a estos estados o fases se le denomina estados de agregación de la materia, porque es de suponer que los cambios de estado pueden darse por una variación de temperatura o presión. Podemos notar que los diferentes estado tienen propiedades y características distintas. Es importante precisar que estos cambios de estado se realizan manteniendo su composición, osea que el agua seguirá siendo agua, así pase de estado solido a liquido o a estado gaseoso.
Nota: Existe otro estado llamado plasmático que ocurre en la estrellas , muy común en el universo.Fuente: CambioDeEstado
Ahora los distintos cambios de estado reciben un nombre dependiendo de su transformación o de a que estado pasen. Veamos
Fusión.- Paso de estado solido a liquido, a traves de un cambio de temperatura o transferencia de calor.
Solidificación.- Transformación de liquido a solido.
Vaporización y ebullición: Ambos procesos llevan a una sustancia de estado liquido a gaseoso, La Vaporización es un proceso lento, por ejemplo por una taza de chocolate caliente en tu mesa y encima una hoja de papel, veras como se forman unas gotas en dicho papel, este proceso se puede dar a cualquier temperatura, obviamente si es mayor la temperatura agiliza las cosas. Ebullición , este es un proceso donde aplico calor para aumentar la velocidad del cambio de estado, por ejemplo el agua a 100ºC, sus moléculas adquieren suficiente energía que empiezan a evaporarse a mayor velocidad.
Condensación.- Cambio de estado gaseoso a liquido. si se pasa de de estado gaseoso a solido de manera directa se denomina sublimación inversa.
Sublimación.- Cambio de estado solido a gaseoso sin pasar por el estado liquido, ejemplo la naftalina.
Punto de fusión .- , Temperatura a la cual materia pasa de estado solido a liquido.
Punto de ebullición .- , Temperatura a la cual materia pasa de estado liquido a gaseoso.
Adicional
Estado de agregación .- Me he dado la tarea de buscar que significa este termino, por agregación vamos a entender que se trata de unión o agrupación, entonces la teoría cinética permite explicar que una materia puede encontrarse en cualquiera de los 3 estados (solido, liquido o gaseoso), dependiendo de como estén agrupados u ordenados las partículas en cada estado.
Fuente: EstadosDeAgregación
Según la real academia
agregación
- f. Unión o adición de una parte a un todo:
agregación de ajo y perejil al guiso. - agregaduría.
La energía se puede transferir de diversas maneras o formas:
Conducción .- La forma mas sencilla de transferencia de calor, se da por el contacto o interacción de dos cuerpos que se encuentran a diferentes temperaturas, después de cierto tiempo ambos cuerpos equilibrarán sus temperaturas llegando así al famoso equilibrio térmico.
Convección .- En este caso, se transfiere calor a través de un liquido o un gas, que fluye por una cañería, digamos de forma mas sencilla, imagina que pones a calentar agua hasta que empieza a evaporarse, y cerca de allí pones un ventilador del otro lado tu mano, sentirás calor por el vapor de agua que llega, cuidado que podrías quemarte.
Radiación.- Aquí se transmite calor a través de ondas electromagnéticas. Ejem. los rayos provenientes del Sol proporcionan energía solar.
8. Ecuación de la conductividad
8. Ecuación de la conductividad
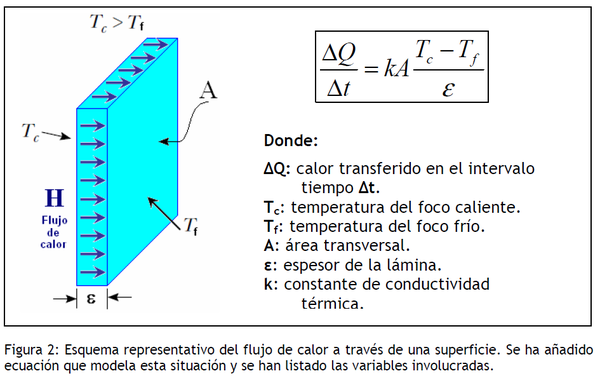
En esta sección veremos la capacidad de conducir calor de cierto material o sustancia, al calentar un material este puede o no conducir el calor dependiendo de sus propiedades atómica, existen materiales que conducen mejor el calor que otros. Es posible hallar la conductividad térmica de un material sometiéndola a transferencias de calor en un intervalo de tiempo a través de una porción del material en cuestión.
Fuente: ConductividadTérmica

No hay comentarios:
Publicar un comentario